Механизм и особенности горения самореагирующих конденсированных систем
Леонов Г.Н., Евстигнеев В.В.
Алтайский государственный технический университет
им. И.И. Ползунова
1.1.Тепловая модель горения конденсированных систем.
Горение является одним из первых сложных физико-химических процессов, освоенных человечеством. Всякий процесс горения является прежде всего химическим процессом превращения исходного горючего вещества в продукты горения с выделением тепла.
Общеизвестно, что скорость всех элементарных химических реакций является непрерывными функциями температуры. Эта температурная зависимость выражается законом Аррениуса, т.е. химические реакции являются существенно нелинейными функциями:
![]() ,
,
где: m- массовая скорость реакции; Е - энергия активации; R - газовая постоянная; T![]() - температура на поверхности горения; B- некоторая постоянная .
- температура на поверхности горения; B- некоторая постоянная .
Из закона Аррениуса видно, что при высоких температурах химическое превращение будет происходить с очень высокой скоростью. А такой физический процесс, как передача тепла из зоны горения к холодным слоям будет много меньше. Следовательно, процесс передачи тепла будет лимитировать весь процесс горения, в частности линейную скорость горения.
Процессу превращения химической энергии в тепловую в общем виде соответствует два процесса: собственно горение и детонация. Если предположить, что для самореагирующих конденсированных систем (СКС) все основные химические превращения с выделением тепла происходят в газовой фазе, то между исходным веществом и продуктами реакции справедливы законы сохранения:
- закон сохранения массы
- ![]() , т.е.
, т.е. ![]() (1-1)
(1-1)
- ![]() (1-2)
(1-2)
- закон сохранения энергии
- 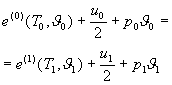 (1-3)
(1-3)
Здесь ![]() соответственно удельная плотность, линейная скорость, внутренняя энергия и температура. Индекс 0 и 1 обозначают соответственно исходное вещество и продукты реакции.
соответственно удельная плотность, линейная скорость, внутренняя энергия и температура. Индекс 0 и 1 обозначают соответственно исходное вещество и продукты реакции.
Из выражений (1-1) и (1-2) можно получить
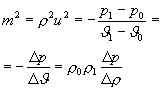 (1-4)
(1-4)
Анализ выражения (1-4) показывает, что для обоих режимов выполняются условия:
![]() <0 ,
<0 , ![]() >0 (1-5)
>0 (1-5)
Из выражения (1-5) следует, что законам сохранения присущи два режима химической реакции с выделением тепла, а именно, когда давление и плотность одновременно либо возрастают либо убывают. При ![]() > 0 и
> 0 и ![]() >0 будет осуществляться режим детонации, а при
>0 будет осуществляться режим детонации, а при ![]() <0 и
<0 и ![]() <0 , будет осуществляться режим горения, его ещё называют тепловым режимом. Линейные скорости этих двух процессов отличаются друг от друга на порядки: тепловой режим имеет порядок от
<0 , будет осуществляться режим горения, его ещё называют тепловым режимом. Линейные скорости этих двух процессов отличаются друг от друга на порядки: тепловой режим имеет порядок от ![]() до
до ![]()
![]() , режим детонации от
, режим детонации от ![]() до
до ![]()
![]() .
.
Так как ![]() > 0 и
> 0 и ![]() >0 осуществляется режим детонации, то вектор скорости продуктов химического превращения будет направлен в туже сторону, что вектор химического превращения, т.е. будет совпадать с вектором скорости детонации. При
>0 осуществляется режим детонации, то вектор скорости продуктов химического превращения будет направлен в туже сторону, что вектор химического превращения, т.е. будет совпадать с вектором скорости детонации. При ![]() <0 и
<0 и ![]() <0 скорости потока продуктов химического превращения будет направлен в противоположную сторону от вектора линейной скорости горения, т.е. продукты горения будут оттекать от поверхности горения. Из этого следует, что волна детонации является волной сжатия, а волна горения будет волной разряжения.
<0 скорости потока продуктов химического превращения будет направлен в противоположную сторону от вектора линейной скорости горения, т.е. продукты горения будут оттекать от поверхности горения. Из этого следует, что волна детонации является волной сжатия, а волна горения будет волной разряжения.
Детонация, как химический процесс с выделением энергии, при применении самореагирующих конденсированных систем для целей метания и движения не применяется и является нежелательным процессом. Поэтому основное внимание уделим лишь собственно горению, т.е. чисто тепловому режиму. При этом процесс энергоприхода должен быть регулируемым. При горении в замкнутом переменном или полузамкнутом объёме энергоприход определяется энергетическими характеристиками продуктов горения и скоростью газообразования. Скорость газообразования в свою очередь зависит от скорости горения и поверхности горения. Поверхность горения можно задавать формой СКС, но возможности изменять форму СКС ограничены по целому ряду причин. Скорость горения СКС является определяющей характеристикой, но которая в меньшей степени подвержена регулированию и расчёту [1-5]. Как правило это чисто экспериментальная характеристика, т.е. для различных прикладных расчетов закон скорости горения должен быть задан в виде аналитического выражения на основе экспериментальных данных для конкретного вида СКС. Так как процесс горения является сложным физико-химическим процессом, то существуют самые различные подходы при описании и моделировании этого процесса. С точки зрения чисто химического подхода данный процесс необходимо описывать через кинетику разложения исходного вещества в конечные продукты горения с учетом всех возможных промежуточных продуктов. Если исходить только из этих позиций, то это будет практически неразрешимая задача. Кинетика горения даже такой простой горючей смеси, как ![]() + тепло реакции, при подробном описании включает более ста промежуточных реакции. Следовательно, для моделирования процесса горения СКС необходимо применять другие подходы, которые бы без ущерба для точности и адекватности, могли помочь не только объяснить, но спрогнозировать наиболее характерные свойства и особенности конкретных рецептур и технологий СКС. В частности объяснить особенности горения СКС со сложной гетерогенной или пористой структурой. Естественно, кинетическую сторону процесса горения необходимо учитывать при любых подходах при рассмотрении процесса горения.
+ тепло реакции, при подробном описании включает более ста промежуточных реакции. Следовательно, для моделирования процесса горения СКС необходимо применять другие подходы, которые бы без ущерба для точности и адекватности, могли помочь не только объяснить, но спрогнозировать наиболее характерные свойства и особенности конкретных рецептур и технологий СКС. В частности объяснить особенности горения СКС со сложной гетерогенной или пористой структурой. Естественно, кинетическую сторону процесса горения необходимо учитывать при любых подходах при рассмотрении процесса горения.
Учет негомогенности СКС можно сделать, если известен механизм горения гомогенной СКС. Под механизмом горения понимается физика процесса горения, на основе которой может быть построена модель горения. Наиболее простой моделью горения СКС является модель горения летучих ВВ [6], предложенная Беляевым А.Ф. в 1938 году. Им, на основе экспериментальных данных было показано, что взрывчатые вещества типа нитродигликоля и нитроглицерина горят по следующему механизму. Сначала ВВ нагревается до температуры кипения, затем происходит испарение и пары, после предварительного разогрева вступают в реакцию собственно горения вдали от поверхности вещества. Вероятность разложения исходного вещества значительно меньше, чем вероятность испарения. Беляевым было показано, что между поверхностью горения и пламенем существует тёмная зона. Зельдовичем Я.Б. было показано, что к этому механизму применима теория горения газовых смесей с некоторыми изменениями [2-4]. Для конденсированных нелетучих систем им была введена газификация к-фазы в г-фазу при соответствующей температуре [1]. Теорию горения Я.Б.Зельдовича называют тепловой теорией горения, т.к. основным лимитирующим процессом является передача тепла из зоны пламени, т.е. зоны выделения основного тепла в зону к-фазы.
Основными допущения данной теории являются следующее:
- рассматривается только плоский фронт горения (пламени), т.е. рассматривается одномерный случай;
- теплопередача происходит только путём теплопроводности, а теплопотери отсутствуют;
При таком описании процесса необходимо учитывать, что одновременно передачей тепла происходит диффузионное перемещение продуктов горения и газов. Следовательно, в наиболее полном виде должны быть одновременно описано и распространение тепла и процесс диффузии. В этих предположениях система уравнений для газовой фазы и устоявшемся режиме горения, когда начало координат совмещено с поверхностью горения и движется со скоростью горения (линейной), будет иметь вид:
![]()
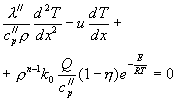 (1-6)
(1-6)
![]() (1-7)
(1-7)
Здесь: ![]() - теплопроводность, удельная теплоёмкость и удельная плотность газовой фазы. T- температура, D - коэффициент диффузии, Q - удельная теплота экзотермической реакции горения,
- теплопроводность, удельная теплоёмкость и удельная плотность газовой фазы. T- температура, D - коэффициент диффузии, Q - удельная теплота экзотермической реакции горения, ![]() - относительная доля продуктов реакции, E,R - энергия активации и газовая постоянная, n - порядок газофазных реакций, u - линейная скорость горения в газовой фазе. Уравнения (1-6) и (1-7) применимы лишь к покоящемуся фронту пламени и через границу раздела (поверхность горения) идет вещество со скоростью горения к-фазы.
- относительная доля продуктов реакции, E,R - энергия активации и газовая постоянная, n - порядок газофазных реакций, u - линейная скорость горения в газовой фазе. Уравнения (1-6) и (1-7) применимы лишь к покоящемуся фронту пламени и через границу раздела (поверхность горения) идет вещество со скоростью горения к-фазы.
Краевые условия будут иметь вид:
при ![]()
![]() и
и ![]() ,
,
при ![]()
![]() и
и ![]() .
.
Уравнения (1-6) и (1-7) справедливы лишь для ![]() . В зоне прогрева к-фазы у нас не будет уравнения диффузии и там не предполагается химических реакций. Для
. В зоне прогрева к-фазы у нас не будет уравнения диффузии и там не предполагается химических реакций. Для ![]() уравнение передачи тепла будет иметь вид:
уравнение передачи тепла будет иметь вид:
![]() (1-8)
(1-8)
Решение для этих двух зон горения нужно склеивать, т.е. необходимо сформулировать дополнительные условия на границе фаз. На границе фазового перехода должны быть равны тепловые потоки с учётом скрытой теплоты фазового перехода и температуры слева и справа от поверхности горения. Это условие можно представить в виде суммы двух составляющих: конвективной и кондуктивной
![]()
Потоки тепла слева и справа от границы раздела фаз должны быть раны между собой:
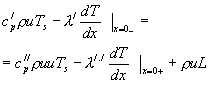 (1-9)
(1-9)
Здесь под величиной L понимается скрытая теплота фазового перехода из к-фазы в г-фазу.
Теперь можно записать соотношение для переноса масс, совершаемое как за счёт диффузии, так и за счёт конвекции:
![]() ,
,
или в виде ![]() (1-10)
(1-10)
Исходя из механизма горения, между поверхностью горения и зоной пламени будет зона подогрева, где химическими реакциями можно пренебречь. Отсекая зону основного тепловыделения, окончательно граничные условия между к-фазой и г-фазой можно записать в виде:
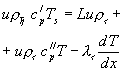 (1-11)
(1-11)
Максимальная температура реакции ![]() может быть найдена исходя из теплового баланса:
может быть найдена исходя из теплового баланса:
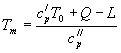 (1-12)
(1-12)
В области к-фазы, где нет химических реакций, можно проинтегрировать от ![]() до x текущего и получить соотношение
до x текущего и получить соотношение
![]() (1-13)
(1-13)
Это соотношение справедливо всюду слева от границы раздела фаз. В частности, при ![]() слева от границы можно записать
слева от границы можно записать
![]() (1-13`)
(1-13`)
Здесь ![]() - температура раздела фаз (температура поверхности).
- температура раздела фаз (температура поверхности).
В рассматриваемой модели горения предполагается подобие полей температур и концентраций (![]() ). Поэтому вместо двух уравнений (1-6) и (1-7) можно рассматривать только одно из уравнений. Чаще всего это будет уравнение теплопроводности.
). Поэтому вместо двух уравнений (1-6) и (1-7) можно рассматривать только одно из уравнений. Чаще всего это будет уравнение теплопроводности.
Подход, примененный Беляевым и Зельдовичем, можно назвать тепловым, т.к. при горении за основу взят процесс передачи тепла, который является лимитирующим. Это подтверждается многочисленными экспериментальными данными.
Основная экзотермическая реакция происходит при температуре, близкой к максимальной, т.е. в г-фазе происходит окончательное тепловыделение и температура достигает своего наибольшего значения, равное термодинамической температуре. Такой подход можно назвать, так же, термодинамическим или энергетическим, т.е. рассматривается в основном тепловая сторона. Так как процесс горения - это самоподдерживающийся процесс, т.е. процесс поддерживается за счет собственного выделенного тепла, то окончательная температура горения определяется составом пороха и эта температура, в свою очередь, определяет тепловой поток из газовой фазы в конденсированную, что , в конечном итоге, и определяет линейную скорость горения. Таким образом, тепловая теория может объяснить общие закономерности, наблюдаемые при горении. В частности, чем выше калорийность пороха, тем выше температура газовой фазы и тем выше тепловой поток их газовой фазы в конденсированную. Если рассмотреть тепловой баланс на поверхности горения, то можно записать
![]() (1-14)
(1-14)
В правой части этого выражения стоит сумма количества тепла, подводимого из г-фазы плюс удельная теплота газификации. Левая часть равенства представляет изменение теплосодержания массы в к-фазе при нагреве от начальной температуры до температуры поверхности. Соотношение (1-14) не учитывает лучистой передачи тепла из зоны пламени в к-фазу. Отсюда можно выразить линейную скорость горения в явном виде:
![]() (1-15)
(1-15)
Подвод тепла к поверхности горения в такой постановке всецело определяется теплопроводностью зоны между поверхностью и пламенем. При стационарном режиме горения тепловой поток можно представить в виде:
![]() (1-16)
(1-16)
Здесь l - ширина зоны в газовой фазе, ![]() -коэффициент теплопроводности газовой фазы.
-коэффициент теплопроводности газовой фазы.
С другой стороны массовая скорость разложения к-фазы, определяемая произведением линейной скорости горения на удельную плотность СКС, т.е. ![]() определяется температурой поверхности
определяется температурой поверхности ![]() в соответствии с законом Аррениуса:
в соответствии с законом Аррениуса:
![]() (1-17)
(1-17)
где ![]() -химическая констана; E - энергия активации; R - газовая постоянная.
-химическая констана; E - энергия активации; R - газовая постоянная.
Экспериментальные данные показывают, что в широком диапазоне давлений значение температуры поверхности изменяется очень мало. Но массовая скорость горения очень чувствительна к изменению температуры поверхности. Согласно экспериментальным данным автора с порохом Н, в диапазоне давлений, где величина скорости горения u изменяется в 3,5 раза величина![]() изменяется всего примерно на 14%. Это подтверждает тот факт, что скорость газообразования (горения) лимитируется не кинетикой химических реакций, подводом тепла к поверхности горения из зоны пламени.
изменяется всего примерно на 14%. Это подтверждает тот факт, что скорость газообразования (горения) лимитируется не кинетикой химических реакций, подводом тепла к поверхности горения из зоны пламени.
Прикладное значение процесса горения во многом определяется не только энергетическими характеристиками СКС, когда продукты горения являются рабочим телом, но и закономерностями горения, которые выражаются видом закона горения ![]() . В настоящее время не существует строгих теоретических методов для точного расчета скоростей горения СКС. Создание таких методов затруднено сложностью и много стадийностью этого процесса и влиянием на него большого числа физических и химических факторов. Поэтому выявление механизма влияния того или иного фактора и создание моделей, их описывающих, является важной составляющей в теории и практике горения.
. В настоящее время не существует строгих теоретических методов для точного расчета скоростей горения СКС. Создание таких методов затруднено сложностью и много стадийностью этого процесса и влиянием на него большого числа физических и химических факторов. Поэтому выявление механизма влияния того или иного фактора и создание моделей, их описывающих, является важной составляющей в теории и практике горения.
В предположении сплошности (гомогенности) СКС вводится понятие нормальной скорости горения, т.е. скорость перемещения фронта горения перпендикулярно ( по нормали ) к горящей поверхности. Эту скорость также называют линейной скоростью горения. Нормальная скорость горения СКС является производной от физико-химических свойств и рецептуры СКС, условий горения , таких как давление и начальная температура СКС. Знание закономерностей горения от всех перечисленных факторов имеет чрезвычайно большое значение для практических целей.
Большую роль в понимании собственно процесса горения СКС, и их прикладного значения является опыт, экспериментальные исследования. Именно опыты и эксперименты позволили построить феноменологическую тепловую модель горения.
На основе данных экспериментов закономерность горения от давления как правило определяется в виде выражения линейной (нормальной) скорости горения ![]() как функции давления. В общем виде эту функциональную зависимость для нормальной температуры можно представить в вид:
как функции давления. В общем виде эту функциональную зависимость для нормальной температуры можно представить в вид:
![]() (2-1)
(2-1)
Здесь a,b и ![]() -некоторые постоянные числа, характерные для конкретного СКС и зависят от рецептуры и технологии ее изготовления. Линейную скорость горения конденсированной системы обычно обозначают просто через
-некоторые постоянные числа, характерные для конкретного СКС и зависят от рецептуры и технологии ее изготовления. Линейную скорость горения конденсированной системы обычно обозначают просто через ![]() с размерностью или м/сек, или см/сек, или мм/сек. Закон (2-1) имеет различные частные выражения, такие как:
с размерностью или м/сек, или см/сек, или мм/сек. Закон (2-1) имеет различные частные выражения, такие как:
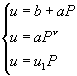
![]() (2-2)
(2-2)
Выражения (2-2(1)) и (2-2(3)) обычно применяются для высоких и сверхвысоких давлений (20¸
500 МПа). Закон горения (2-2(2)) чаще всего применяется при давления до 20 МПа. Показатель степени ![]() в законе горения чаще всего принимает значение в интервале от 0,5 до 1 [1,5].
в законе горения чаще всего принимает значение в интервале от 0,5 до 1 [1,5].
Из соотношений (2-1) и (2-2) видно, что с увеличением давления скорость горения растёт. Однако для некоторых рецептур СКС на определённых интервалах давления наблюдается нулевая или обратная (аномальная) зависимость скорости горения от давления. Если исходить из тепловой теории горения Я.Б.Зельдовича с ведущими химическими реакциями тепловыделения в газовой фазе, то определяющим для показателя ![]() является порядок реакций n, т.к.
является порядок реакций n, т.к. ![]() [3,4]. Значение n=1 характерно для мономолекулярных реакций, которые проходят в к-фазе, а значение n=2 характерно для бимолекулярных реакций, которые происходят в г-фазе. Так как величины a и b предполагаются постоянными в процессе горения, то они несут определённый физический смысл. Так величина b связывается с передачей тепла из зоны пламени в к-фазу за счёт излучения и при высоких давлениях ею можно пренебречь (это будет показано ниже). Величина a или
[3,4]. Значение n=1 характерно для мономолекулярных реакций, которые проходят в к-фазе, а значение n=2 характерно для бимолекулярных реакций, которые происходят в г-фазе. Так как величины a и b предполагаются постоянными в процессе горения, то они несут определённый физический смысл. Так величина b связывается с передачей тепла из зоны пламени в к-фазу за счёт излучения и при высоких давлениях ею можно пренебречь (это будет показано ниже). Величина a или ![]() напрямую связана с природой СКС, её рецептурой. Именно от природы компонентов и их соотношения зависят энергетические характеристики СКС. Чем выше калорийность, тем выше скорость горения и тем большие значения будут принимать величины a или
напрямую связана с природой СКС, её рецептурой. Именно от природы компонентов и их соотношения зависят энергетические характеристики СКС. Чем выше калорийность, тем выше скорость горения и тем большие значения будут принимать величины a или ![]() . Физически это определено более высокой температурой газовой фазы. Если предположить, что расстояние между поверхность горения и зоной энерговыделения с зависит только от давления, то чем выше температура в г-фазе, тем больший тепловой поток будет воздействовать на поверхность горения. Особенно это видно для СКС типа артиллерийских. бездымных порохов, как пироксилиновых, так и баллиститных, которые можно обозначить общим именем – коллоидные пороха, и для которых на основе экспериментальных данных выведены зависимости напрямую связывающие линейную скорость горения с их калорийностью.
. Физически это определено более высокой температурой газовой фазы. Если предположить, что расстояние между поверхность горения и зоной энерговыделения с зависит только от давления, то чем выше температура в г-фазе, тем больший тепловой поток будет воздействовать на поверхность горения. Особенно это видно для СКС типа артиллерийских. бездымных порохов, как пироксилиновых, так и баллиститных, которые можно обозначить общим именем – коллоидные пороха, и для которых на основе экспериментальных данных выведены зависимости напрямую связывающие линейную скорость горения с их калорийностью.
Для давлений свыше 20 МПа наиболее приемлемым законом горения, который лучше всего согласуется с экспериментальными данными является, зависимость (2-2-(3)) с показателем ![]() =1 [1,5].
=1 [1,5].
То, что a или ![]() зависят от конкретной рецептуры, можно показать исходя из тепловой теории горения с ведущими газофазными реакциями тепловыделения. За основу возьмем соотношения (1-15) и (1-16) и предположим, что никаких реакций тепловыделения в к-фазе не происходит. В этом случае массовая скорость горения может быть определена следующим выражением:
зависят от конкретной рецептуры, можно показать исходя из тепловой теории горения с ведущими газофазными реакциями тепловыделения. За основу возьмем соотношения (1-15) и (1-16) и предположим, что никаких реакций тепловыделения в к-фазе не происходит. В этом случае массовая скорость горения может быть определена следующим выражением:
![]() (2-3)
(2-3)
Теперь в (1-22) обозначим через ![]() . Тогда получим простое выражение для массовой скорости горения:
. Тогда получим простое выражение для массовой скорости горения:
![]() (2-4)
(2-4)
При горении закон сохранения массы определяется тем, что ![]() при фиксированной рецептуре и условиях горения. Физический смысл массовой скорости горения заключается в том, что с сгорает определенная масса к-фазы с единицы поверхности в единицу времени. Следовательно, исходя из закона сохранения массы при установившемся режиме горения массовая скорость газификации, т.е. горения, должна равняться массовой скорости газофазных реакций, т.е.
при фиксированной рецептуре и условиях горения. Физический смысл массовой скорости горения заключается в том, что с сгорает определенная масса к-фазы с единицы поверхности в единицу времени. Следовательно, исходя из закона сохранения массы при установившемся режиме горения массовая скорость газификации, т.е. горения, должна равняться массовой скорости газофазных реакций, т.е. ![]() . При этом для массовых скоростей справедливы соотношения:
. При этом для массовых скоростей справедливы соотношения:
![]() и
и ![]() (2-5)
(2-5)
Ширина зоны l- это зона химических реакций, где температура меняется от ![]() до
до ![]() , и её можно оценить следующим образом:
, и её можно оценить следующим образом:
![]()
![]() (2-6)
(2-6)
Здесь: ![]() - скорость движения продуктов газификации по нормали к поверхности от поверхности горения;
- скорость движения продуктов газификации по нормали к поверхности от поверхности горения; ![]() - время завершения химических реакций превращения начальных продуктов газификации в конечные продукты, и где температура возрастает от
- время завершения химических реакций превращения начальных продуктов газификации в конечные продукты, и где температура возрастает от ![]() до
до ![]() . С учетом (2-5) и (2-6) выражение (2-4) для массовой скорости горения можно переписать в виде:
. С учетом (2-5) и (2-6) выражение (2-4) для массовой скорости горения можно переписать в виде:
![]() (2-7)
(2-7)
Теперь необходимо выразить величину t . Так как в этой зоне идут химические реакции, это время можно оценить следующим образом:
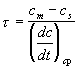 . (2-8)
. (2-8)
Здесь : ![]() и
и ![]() концентрация исходного газообразного вещества на границе между конденсированной и газовой фазами и в зоне максимальной температуры, где выделяется основное тепло, а
концентрация исходного газообразного вещества на границе между конденсированной и газовой фазами и в зоне максимальной температуры, где выделяется основное тепло, а ![]() средняя скорость химических реакций от
средняя скорость химических реакций от ![]() до
до ![]() на отрезке длиной l.
на отрезке длиной l.
Согласно законам химической кинетики для газофазных реакций характерен второй порядок то скорость химических превращений можно описать уравнением вида :
![]() (2-9)
(2-9)
Для газофазных реакций концентрации реагирующих веществ можно выразить произведение их относительной концентрации на удельную плотность, т.е. ![]() . Теперь (2-9) можно переписать в виде :
. Теперь (2-9) можно переписать в виде :
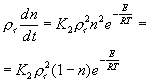 (2-10)
(2-10)
Подставив (2-10) в выражение (2-8) для ![]() и произведя некоторые преобразования получим:
и произведя некоторые преобразования получим:
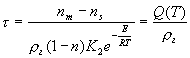 (2-11)
(2-11)
Здесь : 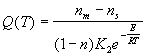 . Подставим выражение (2-11) в выражение для (2-9) для массовой скорости горения. В результате получим :
. Подставим выражение (2-11) в выражение для (2-9) для массовой скорости горения. В результате получим :
![]() или
или ![]() (2-12)
(2-12)
Удельная плотность газообразных продуктов связана с давление и температурой уравнением состояния ![]() . Следовательно окончательно массовая скорость горения может быть представлена в виде :
. Следовательно окончательно массовая скорость горения может быть представлена в виде :
![]() (2-13)
(2-13)
Если обозначить ![]() и ввиду того, что
и ввиду того, что ![]() , то используя выражение (2-13) линейную скорость горения СКС можно представить в виде :
, то используя выражение (2-13) линейную скорость горения СКС можно представить в виде :![]() (2-14).
(2-14).
Формула (2-14) совпадает с формулой (2-2(3)). При этом коэффициент ![]() несет вполне определенную смысловую нагрузку. Это чисто энергетическая, термодинамическая характеристика, т.к. при газофазных реакциях второго порядка она полностью зависит от температуры пламени, которая отражает энергетику конкретной самореагирующей конденсированной системы (СКС). Однако теоретический расчет её затруднителен из-за отсутствия точных численных данных многих постоянных, таких как теплопроводность газовой фазы, энергии активации газо-фазных реакций и т.д. Поэтому, при расчете этого параметра применяются различные эмпирические соотношения, учитывающие либо калорийность СКС, либо её рецептуру, либо и то и другое одновременно. Но нужно заметить, что влияние такого параметра СКС, как его удельная плотность конденсированной фазы, не фигурирует ни в каких выражениях, описывающих горение СКС в зависимости от давления. Теоретически это объясняется просто: от плотности конденсированной фазы скорости реакций в газовой фазе не должны зависеть.
несет вполне определенную смысловую нагрузку. Это чисто энергетическая, термодинамическая характеристика, т.к. при газофазных реакциях второго порядка она полностью зависит от температуры пламени, которая отражает энергетику конкретной самореагирующей конденсированной системы (СКС). Однако теоретический расчет её затруднителен из-за отсутствия точных численных данных многих постоянных, таких как теплопроводность газовой фазы, энергии активации газо-фазных реакций и т.д. Поэтому, при расчете этого параметра применяются различные эмпирические соотношения, учитывающие либо калорийность СКС, либо её рецептуру, либо и то и другое одновременно. Но нужно заметить, что влияние такого параметра СКС, как его удельная плотность конденсированной фазы, не фигурирует ни в каких выражениях, описывающих горение СКС в зависимости от давления. Теоретически это объясняется просто: от плотности конденсированной фазы скорости реакций в газовой фазе не должны зависеть.
Литература
1. Серебряков М.Е., Внутренняя баллистика ствольных систем и пороховых ракет. Оборнгиз, М. 1962 г.
2. Знльдович Я.Б., Дейпунский О.И., Либрович В.Б., Теория нестационарного горения пороха, Наука, М. 1975 г.
3.Новожилов Б.В. Нестационарное горение твердых ракетных топлив, Наука, М. 1973 г.
6. Беляев А.Ф. Горение, детонация и работа взрыва конденсированных систем, Наука,М.1966 г.